Fuerzas de corto alcance
Si la materia fuera totalmente neutra, la química, como ciencia, poco tendría que hacer. No obstante, a pequeñas distancias (de orden molecular) se ponen de manifiesto fuerzas de corto alcance que hacen que el mundo que conocemos sea como es. En nuestra historia de hoy daremos una pincelada sobre esas fuerzas.
En los átomos, los electrones se mueven continuamente alrededor del núcleo atómico y hay momentos en que están en un lado y momentos que están en otro. ¿Y qué sucede si tenemos una carga positiva en un sitio y una negativa en otro? Pues que entre ellas forman un dipolo eléctrico. Esto puede ocasionar que si hay cerca otro átomo, aunque sea neutro, reordene sus electrones acercándolos a las cargas de signo contrario entre sí hacia el primer dipolo.
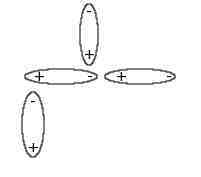
En ese momento, las moléculas estén enlazadas con una fuerza muy débil, pero suficiente como para hacer, por ejemplo, que un gas se vuelva líquido. A estas fuerzas se las conoce como Fuerzas de Van der Waals y su radio de acción se llama, precisamente radio de Van der Waals. Por cierto, que Johannes Diderik Van der Waals se llevó el Premio Nobel de Física de 1910. Estas fuerzas son las responsables de muchos fenómenos físicos y químicos como la adhesión, el rozamiento, la difusión, la tensión superficial y la viscosidad.
Pero hoy quería hablaros, sobre todo, de qué sucede cuando nos lavamos las manos. Si tenemos las manos grasientas y las aclaramos sólo con agua apenas conseguimos nada, pero si añadimos detergente quedan limpias. Bien, ¿cómo funcionan los detergentes que son capaces de mezclarse tanto con el agua como con la grasa cuando ambos, a primera vista, son incompatibles?
Ya Irving Langmuir, alrededor de 1930, se dio cuenta que a los materiales tipo detergente les gusta estar en la superficie del agua porque sus moléculas tienen extremos químicamente diferentes. Uno de esos extremos es «hidrofílico» o amante del agua: le gusta estar en el agua; el otro es «hidrofóbico»: que repele u odia el agua.
Los científicos han acabado tan hartos de esas palabras que llaman a los extremos cabeza y cola. Cuando mezclamos el detergente con el agua y agitamos la mezcla, unas cuantas moléculas se quedarán en la superficie y otras se quedarán dentro del agua.
Si se quedan en la superficie, las cabezas tienden a situarse junto al agua y las colas hacia fuera quedando estrechamente agrupadas (o sea, la parte hidrofílica en contacto con el agua y la hidrofóbica fuera).
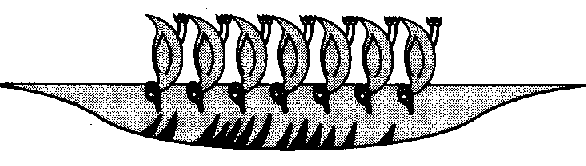
Las que queden bajo la superficie del agua tienen dos opciones. Una de ellas es unir todas las colas de manera que en contacto con el agua sólo queden las cabezas. Es lo que se llama una micela.

En el centro de esa micela se sitúan las partículas de grasa. Como las micelas tienen la parte hidrofílica externa en contacto con el agua se disuelven con ella. Eso es lo que sucede cuando nos lavamos las manos. Las mujeres de la limpieza son, en este caso, unas químicas de primera.
Otro modo de comportarse los detergentes en el agua es formar una bicapa:
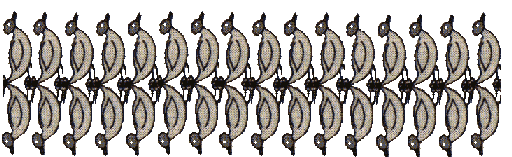
La parte central de las bicapas está cómoda por tener sólo la cabeza tocando con el agua. El problema está en los extremos que pueden ponerse en contacto entre sí y se forma entonces lo que se conoce como un liposoma.

La diferencia más remarcable entre las micelas y los liposomas es que las micelas llevan en su interior sustancias solubles en aceite y los liposomas llevan sustancias solubles en agua.
Las paredes de las burbujas de jabón no son otra cosa que una doble capa de jabón o detergente con las colas orientadas hacia el aire y las cabezas hacia la capa de jabón, en contacto también con una finísima capa de agua, que, además, se evapora con facilidad y da como resultado la pérdida de la estructura y la ruptura de la burbuja a pocos segundos de que se ha formado.
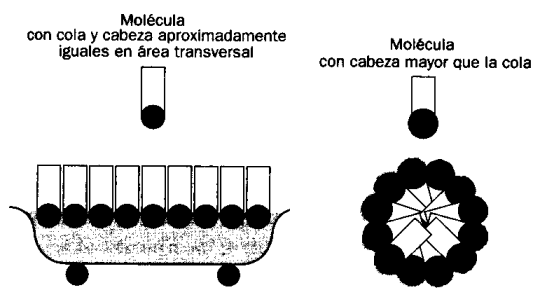
Por supuesto, todas estas cosas están íntimamente relacionadas con la geometría molecular, o sea, la forma que tienen las moléculas en el espacio. Os pongo dos imágenes muy significativas en las que se pueden ver los resultados de tener la cabeza igual que la cola o la cabeza más grande que la cola.
Estamos en 1757, en una travesía marítima donde viajaba Benjamin Franklin. Observó que las estelas de dos de los barcos del grupo eran lisas mientras que la que dejaba su barco y el resto eran encrespadas. Corrió al capitán a explicarle este fenómeno. La respuesta no se hizo esperar: Los cocineros, supongo, deben haber estado vaciando sus grasientas aguas por los imbornales y han engrasado un poco los costados de esos barcos.
Pero Franklin pensó que en realidad el aceite afectaba al agua y no a los barcos. Comprobó esta idea durante 17 años y culminó en un estanque en el Claphmam Common de Londres. El viento rizaba el agua cuando vertió una cucharada de aceite de oliva en la superficie. Con sus propias palabras:
Aunque no era más que una cucharadita, el aceite produjo una calma instantánea en un espacio de varias yardas cuadradas, calma que se propagó de forma asombrosa y se extendió gradualmente (…) haciendo que toda aquella parte del estanque se volviera tan lisa como un espejo.
¡Ay!, Franklin. Querías calmar las olas pero lo que no sabías es que ese mismo experimento se utilizaría más tarde para calcular el grosor de las moléculas. Hoy día sabemos que un película oleosa se extiende formando una capa de una molécula de espesor que permanece unidas gracias a las fuerzas de Van der Waals.
De hecho, 116 años más tarde, Lord Raileigh repitió el experimento en un baño con un volumen de aceite cuidadosamente medido y colocando piezas de alcanfor flotantes para que marcaran los límites de la película. Llegó a la conclusión que el espesor de la molécula era 1,6 nanómetros (1,6 millonésimas partes de 1 mm). Con esa información se pudo saber que la cucharilla de Franklin debía tener un volumen de unos 3 ml, lo que equivale a una de té georgiana de la época.
De ahí a hacer un auténtico instrumento científico con el que medir espesores de moléculas tuvo que hacerlo el propio Irving Langmuir, en 1935.
Unas fuerzas débiles, pero tremendamente decisivas.
Fuentes:
«Cómo mojar una galleta», Len Fisher
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/18/html/sec_6.html
http://castellano.revistaeureka.com/index.php?option=com_content&task=view&id=77&Itemid=50
http://members.tripod.com/plinios/acapulco.htm
http://es.answers.yahoo.com/question/index?qid=20070223144357AAN4Vje











El día 6 de marzo de 2007 a las 09:40
Ahhhh… que recuerdos… las fuerzas de Van der Waals.
Me ha encantado lo de los patitos. Núnca lo había visto así, siempre eran los típicos dibujos de cabeza redonda y cola fina y larga.
Por cierto, en mi empresa trabajamos con un producto que hace micelas, pero en este caso es un aceite. La cuestión es que lo que vendemos es un hongo que coloniza y mata insectos plaga. Las esporas de hongos son muy susceptibles a la luz y a la sequedad, por lo que para protegerla se formula en este aceite. El aceite al mezclarse con el agua para aplicar el producto, forma micelas, dentro de las cuales quedan las esporas protegidas por la fina capa de aceite.
Por otro lado, los liposomas son los precursores de la membrana celular, sin la cual, las primeras bacterias habrían tenido serias dificultades en crearse.
Saludos!!
El día 6 de marzo de 2007 a las 10:12
¡Caray!, Nelor. Muy curioso. Yo sólo había leído de los liposomas que se utilizaban para enviar medicamentos a algún lugar del cuerpo. Se ponía dentro y cuando llegaba al punto se rompía el liposoma y liberaba la sustancia.
Dicen que no es le mejor modo de transportar la sustancia, pero es uno más.
Que una cosa tan simple encierre tanto … 🙂
Salud!
El día 7 de marzo de 2007 a las 10:45
Lo del trasnporte de medicamentos con liposomas lo desconocía. Es muy interesante, y una gran idea.
Esta cosa tan simple es el primer «vestido» que tuvo un ser vivo 😉
Seguro que tienen más aplicaciones que desconocemos.
Saludos!
El día 7 de marzo de 2007 a las 15:50
Lo de los patos muy didáctico. Con tu permiso lo utilizaré a partir de ahora en mis explicaciones.
Saludos
El día 8 de marzo de 2007 a las 00:37
Espera, a ver si me he enterado bien. Esto significa que si echo una cucharada de aceite en un pantano, ¿el aceite se extiende formando una delgada película?
El día 8 de marzo de 2007 a las 09:54
seeep… y además segun se dice en el artículo no hay olas
El día 8 de marzo de 2007 a las 10:06
Gracias, medi, aunque el mérito de la idea es para del autor del libro citado. A mí me encantó.
josera, no soy un espeialista en el tema; es posible que haya aceites que no lo hagan, pero sí, es así.
Proximo: de hecho, se hicieron más experimentos para ver si se podía, realmente, conseguir calmar las olas, por ejemplo, con ácido esteárico. Y de hecho, lo consigue (las estelas de los barcos son bastante significativas); pero cuando las olas pasan de un determinado nivel de fuerza se rompe esa capa y el efecto no puede darse. Una lástima.
Salud!
El día 8 de marzo de 2007 a las 13:15
En la mar se hace uso de este fenomeno en ocasiones especiales. Se dice que un barco capeando un temporal, puede ayudarse por una ancla de capa, que es una lona y otro objeto atado a modo de paragüas, que se libra por proa para ayudar a la embarcacion a enfrentarse a la marejada. Pues en esta caso se recomienda fijar al cabo del ancla un trapo o prenda empapado en aceite del motor o gasoil mismamente, para tranquilizar el oleaje que llega, y ayudar a evitar rociones que salten por las amuras. Se supone que hablamos de emparcaciones pequeñas en temporales no muy fuertes, pues es seguro que no detiene el temporal … jeje
El día 8 de marzo de 2007 a las 13:46
Muy bueno, romir. No lo sabía 🙂
Salud!
El día 8 de marzo de 2007 a las 13:52
Pasmoso. Recuerdo un tebeo de mi ninyez donde, en una escena, un barco creo q pirata se escapaba de sus perseguidores en medio de una tempestad arrojando barriles de aceite por la borda. Ellos se salvaban mientras q a sus perseguidores se los tragaban las olas. En su momento pense’: menuda gilipollez. Pero ya veis, nunca es tarde para aprender.
El día 8 de marzo de 2007 a las 22:39
Hurakanpakito, yo había leido que durante la segunda guerra mundial cuando un barco tenía que rescatar naufragos de un submarino u otro barco, se situaban a barlovento de los naufragos y arrojaban una cantidad de aceite por la borda para que las aguas se calmasen y así poder izarlos a bordo.
También he oido hablar de los buceadores griegos de la antiguedad que se sumergían con la boca llena de aceite que dejaban escapar poco a poco ante sus ojos para así igualar su densidad al del humor vitreo de los ojos y poder ver claramente bajo el agua.
Como se vé, la cosa viene de antiguo.
Saludos a todos.