Radios atómicos
Hoy me acompañaréis a dar un paseo por la tabla periódica (recordad a Mendeleyev), os hablaré de núcleos, electrones y radios atómicos. De paso, sacaremos alguna conclusión que es, como mínimo, sorprendente.
Hagamos un poco de memoria. En el año 640 aJ, Tales de Mileto formuló una pregunta: ¿de qué esta hecho el Universo? Más de 2.000 años el hombre ha buscado la respuesta a esa pregunta en lo que ha sido y es la mayor y más apasionante historia de detectives.
Los griegos pensaban que el Universo estaba compuesto por cuatro elementos básicos: tierra, aire, agua y fuego. Hace unos 200 años, Lavoisier fundó la química moderna que era capaz de identificar unos 30 elementos químicos. La lista ha aumentado desde entonces a 110. Son tantos que ni siquiera los químicos se molestan en bautizarlos: les nombran directamente por su número atómico. Todos ellos han encajado en la Tabla Periódica de los Elementos.
En primer lugar hay que recordar que las cargas de signo contrario se atraen con la fuerza que da la Ley de Coulomb. Os la escribo (sin tener en cuenta los signos):
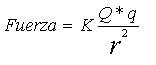
No os dejéis impresionar: es idéntica la ley de la Gravitación Universal de Newton. La gran diferencia es que en vez de haber masas, hay cargas eléctricas. Además se atraen de igual manera: en función del cuadrado de la distancia. Hay que decir, además, que en igualdad de condiciones ganan las cargas. Por ejemplo, si comparamos la atracción gravitatoria entre dos electrones y la fuerza de Coulomb que las separa, la fuerza eléctrica ni se entera de la fuerza gravitatoria.
Para que no tengáis que echar ojo continuamente de la tabla cuando nombre un elemento pondré entre paréntesis el número atómico, o sea, número de protones que contiene su núcleo y que da la carga positiva del mismo.
Dejando de lado el Hidrógeno (1) y el Helio (2) empezamos por el litio (3), berilio (4), boro (5), etc. Basta mirar la tabla periódica para verlos.

A medida que el núcleo aumenta su carga es lógico esperar que atraiga a los electrones con más fuerza y esto debería repercutir en que el radio atómico fuera menor. Aquí la lógica cuadra: el radio atómico del litio (3) es 1,55 Å (ángstroms); el del berilio (4) 1,12; el del boro (5) 0,91; etc. Efectivamente, a medida que el núcleo crece en carga positiva tira con más fuerza de los electrones que le rodean y sus órbitas tienden a acercarse a él. Así que si nos movemos de izquierda a derecha en la tabla periódica iremos encontrando radios atómicos cada vez menores.
Esto también repercute en la dificultad de arrancar electrones a los átomos (Energía de ionización). Al ser atraídos con más fuerza por el núcleo necesitaremos más energía para arrancar dichos electrones. En ese caso dejaríamos al átomo positivamente cargado, teniendo un ion positivo o catión.
Ahora, en vez de movernos de izquierda a derecha, hagámoslo de arriba a abajo. Miremos la columna de los metales alcalinos: la primera de la izquierda (litio (3), sodio (11), potasio (19), rubidio (37), cesio (55)). Podríamos pensar, con la misma lógica anterior, que a medida que aumenta la carga del núcleo atómico tirará con más fuerza de los electrones y reducirá el radio atómico. Pues no, ahora entra en juego otro factor decisivo.
Resulta que todos los metales alcalinos tienen un solo electrón en la órbita más externa. Aunque aumentamos el número atómico, también hablamos de otra capa atómica más externa y que está a mayor distancia del núcleo. El electrón externo del litio está en la segunda órbita; el del sodio en la tercera; etc. Y por si fuera poco, el electrón externo no es atraído con más fuerza. De hecho, sólo ve una carga positiva. Por ejemplo, si el litio tiene 3 protones y 2 electrones en la primera capa: ese último electrón verá una carga positiva de 3-2=1; en el caso del cesio serán los 55 protones del núcleo menos los 54 electrones de las capas interiores: 55-54=1. Así pues el electrón externo, a grandes rasgos, ve una sola carga positiva desde fuera. La carga nuclear, por tanto, no tiene consecuencias significativas para esos distantes electrones de la capa añadida.
Esto, por supuesto, también repercute en las energías de ionización que disminuyen de arriba a abajo; pues a medida que vamos añadiendo capas, nos vamos alejando del núcleo. Por ejemplo, la del cesio es un 75% de la del litio.
Ahora bien, a todo lo que os acabo de decir le voy a dar la vuelta. Si hay mayor facilidad para perder electrones, habrá mayor dificultad para capturarlos. O sea, si para perder un electrón decíamos que era más fácil a medida que bajábamos en la tabla y estábamos más a la izquierda, los elementos que mejor capturen electrones estarán más arriba y a la derecha. En ese caso, quedaría cargado negativamente (un electrón de más) y se llamaría ion negativo o anión.
Conclusión: encontramos aniones (iones negativos) más fácilmente en la parte superior derecha de la tabla y cationes (iones positivos) en la parte inferior izquierda.
Se excluyen los gases nobles que tienen todas sus capas llenas en la columna de la derecha de todo. ¿Sabéis por qué se llaman nobles? Pues porque como en un tiempo la nobleza no se mezclaba con el resto del mundo el símil estaba servido.
Cuántas conclusiones podemos extraer sólo haciendo cuatro números con la tabla periódica, ¿no?!. Después de haberos dado esta pincelada, voy a explicaros otro detalle. ¿No os habéis preguntado nunca por qué las densidades de los elementos que conocemos en la Tierra son tan semejantes? No varían apenas en órdenes de magnitud. Las densidades de todos los materiales oscilan, aproximadamente, entre 1 y 10 g/cm3. A primera vista, parece no tener sentido si pensamos que el número de nucleones (protones más neutrones) puede oscilar desde 1 para el hidrógeno y hasta números bien grandes como 238 para el uranio. Parece que deberían existir materiales con densidades del orden de 200 g/cm3.
Lo mejor en estos casos es hacer cálculos y ver qué pasa. Tomemos esos dos ejemplos anteriores. El hidrógeno tiene un radio atómico de 0,75*10-8 cm. El uranio con sus 238 protones tiene un radio sólo 3 veces mayor: 2,2*10-8 cm. La masa aproximada de un neutrón y un protón (un nucleón) es de 1,7*10-24 gramos (la de los electrones se desprecia). Bien, si la densidad es la masa dividida por el volumen, ya podemos calcular la del hidrógeno y la del uranio: un sólo nucleón contra 238.
Vamos con el hidrógeno:
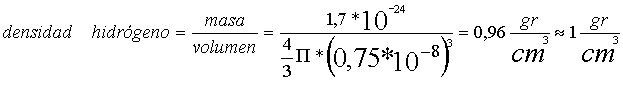
Y ahora con el uranio:
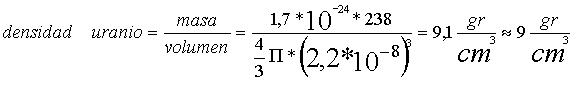
Acabamos de deducir que el hecho de que no haya materiales mucho más densos que el plomo y el uranio o mucho menos densos que el agua están relacionados directamente con cantidades fundamentales de la física atómica como el radio y la masa del átomo. ¿No os parece una deducción sorprendente?
Espero que el paseo haya sido de vuestro agrado.
Fuentes:
«El secreto de la química», Gianni Fochi
«El panorama inesperado», James S. Trefil
«El encanto de la física», Sheldon L. Glashow
«La búsqueda de los elementos», Isaac Asimov
http://es.wikipedia.org/wiki/Tabla_peri%C3%B3dica_de_los_elementos
http://es.wikipedia.org/wiki/Energ%C3%ADa_de_ionizaci%C3%B3n
http://es.wikipedia.org/wiki/Angstrom











El día 16 de octubre de 2006 a las 09:14
Creia que el elemento 87 era el Francio. Por lo menos era lo que yo estudié. Muy buen artículo, felicidades
El día 16 de octubre de 2006 a las 09:39
Ahora que hablas de la tabla periódica, alguien dijo una vez que «la tabla periódica de los elementos químicos es quizás el cuadro más elegante jamás inventado», más o menos.
Desde luego, ha sobrevivido suficiente tiempo como para que Mendeleyev se merezca todos nuestros respetos (dicen que se le ocurrió la idea a partir del juego del solitario, no?)
Saludos!!
El día 16 de octubre de 2006 a las 10:20
Jorge: efectivamente, es el francio. No sé por qué esa tabla periódica está equivocada.
Esteban: efectivamente, en el link (que estaba mal, por cierto) a Mendeleyev del artículo sale lo que dices. Ahora lo corrijo.
Salud!
El día 16 de octubre de 2006 a las 10:20
Como siempre muy interesante 😀
Por cierto, justo hoy aparecía la noticia de la reciente creación del elemento más pesado hasta ahora: El 118 (Ununoctio).
Salu2 🙂
El día 16 de octubre de 2006 a las 12:10
Es pasmoso cómo algo tan elegante y, en apariencia, tan simple, dice tanto sobre los elementos. Qué tío Mendeleiev.
Por cierto, cuando yo la aprendí todavía no existían los elementos del 104 a 111, así que no me sé sus nombres…
El día 16 de octubre de 2006 a las 12:12
Perdón, no había leído que ya hay 118…
¡Qué viejo me siento!
El día 16 de octubre de 2006 a las 14:32
Cierto, omalaled, ya sabía yo que me sonaba aparte de haberlo leido en el libro de Bryson (Una breve historia…). Me extrañaba que antes pareciese un link pero que no lo fuese al fin y al cabo.
Saludos!
El día 16 de octubre de 2006 a las 17:22
Haces que parezca tan fácil…
En mi adolescencia, me limité a aprender (entonces tenía muy buena memoria) las columnas de la tabla que entraban en cada examen. Recuerdo que estudié que Mendelyev, cuando hizo la tabla, dejó sitio para elementos que en su tiempo no se habían descubierto y que luego aparecieron, justo con las caracerísticas que él había predicho. Pero lo tomé por cosa de magia.
Nunca me explicaron el asunto del radio atómico (la expresión suena a arma de Mazinger Z, la verdad), y ahora me doy cuenta de que es la clave, por lo menos, para que yo consiga entenderlo.
Al final, conseguirás que entienda la química 🙂
El día 16 de octubre de 2006 a las 18:19
mimetist: otro gas noble 🙂
Jorge y Esteban: la tabla de Mendeleyev es una maravilla. Es una lástima que no se explique a los alumnos su significado en profundidad, solitario incluido.
JDJ: es que las cosas no tienen por qué ser difíciles. Serás tú quien consiga que nos guste la historia.
Salud!
El día 16 de octubre de 2006 a las 21:18
lo que nunca he entendido porque hay esas dos filas de elementos separados de la tabla
El día 16 de octubre de 2006 a las 21:23
En Tecnología obsoleta sacaron el otro día otra representación de la tabla periódica en espiral, que parece que resuelve problemas con los elementos que quedan descolgados.
El día 16 de octubre de 2006 a las 23:28
Pedrito: se ponen así por comodidad. En realidad, deberían estar justo después del La (lantano) y del Ac (actinio) y desplazar a la derecha a partir de la columna 4B (mira la tabla periódica). Pero sería mucho más ancha. Se ponen fuera y se acabó. Seía análogo a retirar todo el mazacote central (desde la columna 3B a 2B) y juntáramos la 2A y la 3A. En la wikipedia deberían estar donde los asteriscos. Si se siguieran descubriendo elementos habría que extenderla
La razón está en los números cuánticos de los orbitales … ufff, a ver si algún día me animo y lo explico con detalle. Espero haber aclarado algo.
In I go: desconocía esa tabla y la verdad es que es también una bonita forma de representarlos.
Salud!
El día 16 de octubre de 2006 a las 23:33
Me da la sensación, omalaled, de que muchas veces se banalizan las cosas más habituales, como puede ser la tabla periódica para los profesores de primaria (o secundaria, cuándo se aprendía?)… normalmente, lo que yo recuerdo es poco entusiasmo al explicar las cosas, y eso lo que provoca es que perdamos la perspectiva y le demos poca importancia.
Eso luego, si tienes suerte, lo irás aprendiendo con cada cosa que lees (algo escogida, claro). Creo yo… Si todos hubiesemos tenido un Puig Adam… 😉
El día 17 de octubre de 2006 a las 10:59
Pues yo recomiendo enardecidamente a los estudiantes de química que se la aprendan de memoria y comprendan bien la relación entre elementos en cuanto a peso atómico, número atómico y capas de electrones.
Tan solo con eso logré aprovar un difícil examen de «Estructura química de la materia». La clave está en saber la tabla de memoria y comprender la estructura de las distintas capas de electrones y cómo se disponen (Omalaled ya ha «amenazado» con explicarlo bien).
Pero, por supuesto, aconsejo también que se estudien el resto de la materia, que yo solo saqué un 5,75 pelado.;)
Muy buen artículo!
Nelor
El día 17 de octubre de 2006 a las 16:59
Nelor, un 5,75 no es un número pelado. Se acerca más al bien que no al sufi. El principal experto en sacar auténticos 5s pelados, garantizo que soy yo 🙂
Puedo decir (sin orgullo) que he hecho muuuuuuchos más exámenes que no asignaturas aprobadas 🙂
¡Qué se le va a hacer!, uno dista mucho de ser un genio.
Salud!
El día 17 de octubre de 2006 a las 23:01
«Todas las cosas están formadas de átomos…»
El gran físico Richard Feynman decía que si algún cataclismo destruyera todo el conocimiento científico y solamente se pudiera heredar una frase a la generación sobreviviente, él elegiría esta: «todas las cosas están formadas por átomos» -pequeñas partículas que se mueven con movimiento perpetuo, atrayéndose unas a otras cuando están separadas por una pequeña distancia, pero repeliéndose cuando se las trata de apretar una contra otra-. Para Feynman, esta es la frase que contiene el máximo de información con el mínimo de palabras.
El día 17 de octubre de 2006 a las 23:02
Estupenda explicacion, si señor. A nosostros nos decian que cuanto mayor era el numero atomico, un elemento es mas «metalico», es decir, el cloro es mas metalico que el fluor y el sodio mas que el litio, pero no nos decian por que.
El día 18 de octubre de 2006 a las 09:57
Je, je, Omalaled, pero lo que no he contado es que esa fue la única asignatura que aprové en el primer año de universidad, y tan solo era de 35 horas (3,5 créditos)!! ¿Un triunfo o un fracaso?
Marfil, esa frase es genial, y yo diría que resume los conocimientos de fisica y química de un curso entero de primaria o secundaria.
Nelor
El día 18 de octubre de 2006 a las 10:03
Por cierto, mirad que invento más adecuado para el artículo:
http://www.nopuedocreer.com/quelohayaninventado/?p=930
Nelor
El día 18 de octubre de 2006 a las 10:39
.Marfil.: es una de las mejores frases de Feynman. Estoy de acuerdo con el apunte de Nelor.
josemi: me alegro que te haya servido, al menos, para tener una explicación razonable que espero no se te olvide 😉
Nelor: lástima, pues yo tengo mampara. A ver el día que se animan y compro una para mis peques.
Salud!
El día 18 de octubre de 2006 a las 22:53
omalamed queria felicitarte por este blog que me encanta leer por lo facil que haces entender los temas que tocas.
Por otra parte sobre le tema de hoy, en concreto los resultados de las densidades que obtienes, deben ser las de los átomos del higrógeno y del uranio. La densidad del gas higrógeno ronda los 0,08 kg/m3 y la del uranio los 19050 kg/m3. Como ves la relación es de unas 200000 veces.
un saludo
El día 19 de octubre de 2006 a las 00:03
Gracias, anset.
Veamos, en el Uranio sale, efectivamente, esa densidad si consideramos el radio 1,75 *10-8 cm (dato de la wikipedia), cuando yo lo he considerado de 2,2 *10-8cm (dato del primer libro citado en fuentes). Sea como sea, donde quería resaltar la importancia es en el orden de magnitud más que en el número exacto.
No puedo ser más exacto, pues tendría que ir a las formas cristalográficas (que si FCC o BCC) y allí podríamos hablar de empaquetamientos y demás. Uffff, se complica mucho la cosa.
Y bien, respecto el gas de hidrógeno … También podría decir que la densidad el agua es 1 gr/cc, pero cuando se evapora no es tal. Al hablar de densidad del átomo de hidrógeno consideraría uno pegadito al otro como buenos amigos 🙂
Salud!
El día 13 de diciembre de 2006 a las 23:30
Magnífico el artículo.Las fórmulas matemáticas que demuestran que las densidades de los elementos aparentemente más pesados no difieren tanto de las de los aparentemente menos pesados están claras, pero, en definitiva, con palabras para profanos, ¿significa que un cm. cúbico de uranio tiene un número de átomos mucho menor que el que hay en un cm. cúbico de hidrógeno, debido a que su radio es mayor, y ocupa así mayor espacio?
El día 14 de diciembre de 2006 a las 00:43
Gracias, Gandis. Cuando he hablado de densidades me he referido a un solo átomo. No he tratado si eran muchos, pues los átomos se empaquetan de diferentes maneras.
No es lo mismo hidrógeno líquido que hidrógeno gas y ambos son los mismos átomos, pero dispuestos de forma diferente. Yo sólo he tratado un solo átomo para dar órdenes de magintud y no números exactos.
Lo que se desprende es que si la masa aumenta, el radio (y por consiguiente el volumen) también y la densidad no queda muy afectada.
Salud!